Desde ESOF / Optogenética y cerebro: “es la tecnología, estúpido”
Resumen de la charla en el congreso ESOF del psiquiatra-ingeniero Karl Deisseroth. Sobre la revolución de sus métodos: la optogenética, que permite controlar neuronas con luz, y CLARITY, que literalmente hace los cerebros transparentes.

Escritor y periodista científico. MD, PhD

Basta fijarse en su peculiar mirada, en un cierto rictus que lo asalta, para sentir que las cosas encajan. Karl Deisseroth —el considerado padre de la optogenética— es médico y es psiquiatra.
(¿recuerdan a Jonathan Crane, el psiquiatra que aparece en las últimas de Batman?)
Pero no, es un prejuicio equivocado y absurdo. Porque de no corregirlo, de seguir tirando de él, pensaríamos que Deisseroth —como buen psiquiatra— es además un médico particularmente humanista, preocupado sobremanera por la narrativa de la enfermedad mental, centrado en su discurso. Y si por algo Deisseroth está en Copenhague no es por ninguna de esas razones, sino por liderar un departamento de bioingeniería
(ajá, ingeniería)
y haber sido el principal impulsor de la técnica conocida como optogenética, o lo que es lo mismo, de los estudios que posibilitan el control de células (principalmente células nerviosas) mediante la luz. La misma técnica que promete revolucionar los estudios del cerebro, que fue escogida en 2010 como método del año por la revista Nature y que ha hecho que esta misma revista le nombrara el año pasado como “Method man” (el hombre método). Y especialmente de ella habló Deisseroth (el ingeniero-psiquiatra) en Dinamarca:
Comienza su charla como lo hace con alguno de sus artículos: cifrando la complejidad del cerebro humano. Y, sobre todo, señalando la falta de un modelo para poder compararlo. Porque el corazón, por ejemplo, es una bomba, y actúa como tal. Y si en algún momento falla podemos (más o menos) medirla, entenderla e intentar repararla. Pero el cerebro, con sus 90.000 millones de neuronas y 10.000 conexiones por cada una de ellas, y con sus propiedades “emergentes” (¿la conciencia?) es algo mucho más complicado. Porque además no hay un modelo estrictamente “normal” que nos sirva de referencia. Pero también porque las herramientas que usamos para estudiarlo son bastante groseras: podemos observar cambios de actividad, podemos estimular ciertas áreas, pero en general las técnicas no son lo finas que desearíamos. Lo que Deisseroth se proponía al comenzar sus investigaciones era conseguir activar neuronas “individualmente”. De esta forma las conclusiones no solo serían más precisas, sino que además permitirían establecer cierta causalidad: si al activar este tipo de neuronas sucede esto otro, puedo suponer que hay una relación directa. Y para ello echó mano de ciertas proteínas de algas y bacterias que se conocían ya treinta años atrás: las rodopsinas.
Un canto a la investigación básica
Las rodopsinas son unas moléculas muy peculiares. Reaccionan a determinados tipos de luz, y al activarse son capaces de descargar toda una serie de señales dentro de las células. (Un tipo particular de ellas pueblan, por ejemplo, los bastones de nuestras retinas, y se activan en condiciones de semioscuridad.) Ya desde los años 70 se sabe que ciertas bacterias y algas disponen de ejemplos de ellas, lo que les ayuda a captar información del exterior y dirigirse hacia zonas con luz. Pero por entonces, quienes las descubrieron no estaban pensando ni mucho menos en sus posibles aplicaciones. Nada relacionado con el estudio del cerebro pasaba (paradójicamente) por sus cabezas. Según Deisseroth, las estudiaban simplemente “porque eran maravillosas”. No fue hasta 30 años después que los científicos pensaron en aprovecharlas. Y fue el equipo de Deisseroth quien lo consiguió de una forma más simple y eficaz. Más o menos, y brevemente, así:
Primero se inserta el gen de la rodopsina en cuestión en un tipo particular de virus, que funcionará literalmente como un “taxista” celular. Después el virus se inyecta en una zona determinada del cerebro: así, cuando infecta las células también introduce el gen de la rodopsina en el ADN de las neuronas que se quieran estudiar. Por último, se hace llegar una fibra óptica finísima hasta esa misma zona cerebral, lo que permitirá iluminar (y activar) las neuronas que se han “infectado” con las rodopsinas. De ahí el nombre de optogenética: la combinación de técnicas genéticas con la aplicación de luz para conseguir cosas como la de este vídeo: que cuando la luz azul llega hasta las neuronas motoras del ratón, este no pueda dejar de correr:
Las primeras contribuciones
Aunque los estudios y datos proporcionados por la optogenética empiezan a crecer exponencialmente, Deisseroth comentó fundamentalmente dos de ellos:
En el primero de ellos, de 2011, introdujeron rodopsinas en dos partes muy concretas de la llamada amígdala cerebral. Esta es una pequeña zona situada en lo más profundo del lóbulo temporal y es la principal responsable de que sintamos miedo (y de que SM, cuya amígdala fue destruida por una enfermedad degenerativa sea incapaz de sentirlo). Además, su activación constante está relacionada con el desarrollo de ansiedad generalizada. Pero, contrariamente a lo esperado, y a pesar de su reducido tamaño, no toda la amígdala ejerce la misma función. La estimulación con luz de una pequeña parte reducía inmediatamente los signos de ansiedad, pero no sucedía así si se repetía con una región vecina. ¿Es esto importante? Puede serlo, y no solo en el caso de la ansiedad.
– Por ejemplo: los casos de depresión resistente (aquella que no mejora ya con ningún tipo de tratamiento) se están empezando a tratar con la estimulación eléctrica de una determinada zona cerebral, la llamada área 25. Parece que muchos pacientes mejoran, pero aún no se sabe exactamente por qué. Es posible que la optogenética pueda servir para estudiar la razón y, sobre todo, para precisar qué grupos particulares de neuronas son aquellas a las que el tratamiento se debería dirigir.
– Otro ejemplo: los pacientes con párkinson que no responden al tratamiento se tratan mediante la estimulación del llamado núcleo subtalámico. Como en el caso de la depresión, tampoco se sabe con completa exactitud qué es lo que sucede para que los pacientes mejoren. Además, dicha estimulación no es completamente específica, y hay zonas vecinas que también reciben esa señal. De momento la optogenética ya ha servido para dos cosas: para comprobar algunas de las hipótesis que se tenían sobre los circuitos implicados y para observar que es mejor estimular, no tanto a las neuronas en sí, sino las conexiones que establecen entre ellas.
En el segundo estudio que Deisseroth menciona añadieron un paso más: introdujeron una serie de fibras que les permitía medir cómo se desplazaba el calcio en determinadas neuronas. El movimiento del calcio es casi un sinónimo de que esas células se estaban activando, es decir: podían saber el momento exacto en que una región comenzaba a trabajar. De esta manera, combinando la activación mediante la optogenética de un área determinada y la medición del flujo de calcio en algunas de sus conexiones (la barra roja en el siguiente vídeo), lograron identificar un circuito “social”, el circuito preciso que se activa cuando un ratón se “relaciona” con otro ratón (y que no es mero fruto de la novedad, porque no se activaba, por ejemplo, cuando les ponían delante una —tan extraña para ellos— pelota de golf).
Un paso más
Todo esto era impensable sólo diez años atrás, y ya por esto Deisseroth suena como candidato al premio Nobel. Pero no se limitó a explotar el invento. Añadió uno más. Y sí, en el fondo es otra obra de ingeniería:
Una parte del cerebro es la actividad de sus células. Pero otra, no menos importante, es su estructura, las relaciones que se establecen entre ellas. Y su estudio es de lo más complicado. Generalmente pasa por hacer cortes en láminas finísimas que luego se van tiñendo según lo que se quiera estudiar. Al final, según el tiempo, la capacidad y el dinero disponible, se integran los datos obtenidos para tratar de hacer un modelo tridimensional lo más parecido posible a la realidad. El equipo de Deisseroth trató (y al parecer consiguió) simplificar enormemente ese proceso. Al método empleado lo llamaron CLARITY, acrónimo de la técnica empleada, en la que la claridad aportada viene precisamente de que han conseguido hacer transparente el cerebro: usando una serie de jabones han logrado retirar la capa de lípidos (de grasas) que envuelven a cada célula, pero manteniendo perfectamente la estructura general. De alguna manera han dejado completamente expuesto el esqueleto cerebral. Y además eso lo ha hecho poroso, porque permite aplicar prácticamente todos los “tintes” que se usan para estudiarlo. El resultado, imágenes como estas.
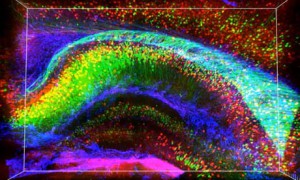

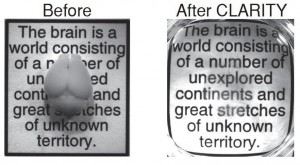
***
La charla termina. Comienzan las preguntas. Algunas de ellas se dirigen, como es lógico, a sus posibles aplicaciones, a si es posible emplear la optogenética directamente en humanos. Deisseroth cree que técnicamente es factible, solo que todavía es pronto. Pero no le preocupa. Al menos de momento no se obsesiona con el traslado de sus “inventos” a la clínica. Aún está preocupado por lo básico, por todo lo que la tecnología puede ayudar a la hora de formular hipótesis. Porque muchas veces sin las herramientas adecuadas no aparecen las preguntas necesarias.
O la respuesta, ahora ya sí, que se puede esperar de un psiquiatra ingeniero.
*
(Este es el segundo texto que publicamos a partir de las conferencias que tuvieron lugar en el congreso ESOF, en Copenhague, donde estuvimos como corresponsales de Tercer Milenio. La primera, “Una historia moviéndose en cada punto de la gráfica”, la puedes ver aquí o aquí.)




